EXPERIMENTO DE BOYLE


Robert Boyle (1627-1691)

Robert Boyle nació en Irlanda el 25 de enero de 1627.
Hombre considerablemente rico, consagró su vida a la ciencia y a la religión. Sus
conocimientos científicos fueron considerables y no realizó ningún descubrimiento
de gran importancia conceptual, ni llevó su trabajo más allá de sus estados
preliminares. Tuvo muy alta reputación por el número de contribuciones.
A la edad de ocho años fue a residir a Eton, donde
demostró aptitud para el estudio y una gran disciplina.
De 1641 a 1642 vivió en Florencia; ahí conoció a
Galileo, siendo el primero en estudiar los trabajos de éste. A la edad de 17 años,
hecho ya un científico práctico y riguroso, regresó a Inglaterra. Fue miembro del
Philosophical College, más tarde incorporado a la Royal Society.
Desde muy pequeño tuvo gran interés por la química,
rechazó la alquimia, contribuyó a establecer la química como ciencia pura. En 1661
publicó un libro escrito en forma de diálogo intitulado: The Sceptical Chymist or
Chymico Physical Doubts and Paradoxes, en el cual definió un elemento químico como
una substancia simple, pura, la cual no podía dividirse en otras más simples por
ninguna acción física o química. Se fundamentó en gran parte, en la hipótesis
atómica de Demócrito. Hizo distinción entre mezclas y compuestos, preparó fósforo
y desarrolló un método de análisis de varias sustancias. Desafortunadamente sus
ideas químicas tuvieron poco efecto inmediato, hasta que Antoine Lavoisier
(1843-1794) las revivió.
En 1654 Boyle se estableció en Oxford donde montó un
laboratorio privado (un asistente fue Robert Hooke). Tres años después, habiendo
aprendido de Otto von Guericke’s (1602-1686) la invención de la máquina de vapor,
se propuso construir una, por lo que empezó sus investigaciones sobre las propiedades
del aire. Demostró sus propiedades elásticas, que tenía peso, estudió el papel de
la respiración y la combustión en la transmisión del sonido. Sus primeros
resultados fueron publicados en Oxford en 1660 bajo el título de New Experiments
Physico-Mechanical Touching the Spring of the Air and its Effects (Nuevos Experimentos
físicos mecánicos referentes a la elasticidad del aire y sus efectos). La segunda
edición en 1662 contenía su demostración experimental de la relación recíproca
entre volumen y presión de un gas (aire), comúnmente conocida como Ley de Boyle.
Mientras que la aproximación de estas medidas dejó mucho que desear, fueron lo
suficientemente convincentes para ser aceptadas. Boyle no atribuyó mucha importancia
a su descubrimiento cinco años más tarde Edmé Mariotte descubrió la misma
relación independientemente.
Boyle se cambió a Londres en 1668, donde residía la
Royal Society de la cual fue miembro fundador. Presentó sus resultados ante sus
compañeros, entre los cuales se encontraba Newton, fue electo presidente de la Royal
Society en 1680, él declinó el honor porque no podía suscribir el juramento, pero
contribuyó grandemente al crecimiento de la sociedad.
Para hacer evidente que la elasticidad del aire es
capaz de hacer mucho más de lo que le atribuimos, tratamos en los siguientes
experimentos sobre de la razón de la elasticidad y volumen del aire.
MEDIDA DE LA CONDENSACION DEL AIRE
Teniendo mercurio puro en un tubo de vidrio en forma de
J cerrado en el extremo más corto, colocamos a cada lado del tubo una tira de
papel dividida en pulgadas, y cada una de éstas en ocho partes; y vaciando dentro del
tubo mercurio, por la parte larga, observamos que el aire contenido en el tubo corto,
el cual estaba herméticamente cerrado en la parte más alta de éste, era condensado
por 29 pulgadas de mercurio, a la mitad del espacio que ocupaba antes, de donde se
muestra, que si fue capaz de comprimirse a un estado tal, por virtud de su
elasticidad, al resistir un cilindro de mercurio de 29 pulgadas, además del cilindro
atmosférico obligatorio sobre él, se deduce que la compresión del aire abierto, a
la mitad cuando más, debe tener la mitad del peso de la atmósfera que está sobre
ella en el estado comprimido (el doble de la presión decrece a la mitad del volumen).
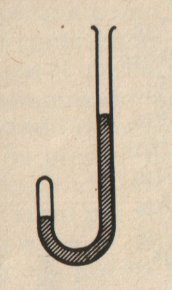
FIGURA 1
Para ser más exactos, consideremos el tubo representado por la
figura 1, colocando en el brazo más corto un papel, dividido en doce pulgadas y cada
una de éstas en cuartos, que dividimos en pulgadas y éstas a su vez en cuartos.
Estando así marcado el tubo, el extremo más bajo fue colocado en una caja de madera,
de modo que el mercurio podía corre en ella si la pipa sufría una rotura. Uno estuvo
asignado a observar cuando el mercurio subía en el tubo pequeño a cada una de las
divisiones mencionadas y llevaba notas, además veía cuál era la altura en el tubo
largo al mismo tiempo; por lo que se efectuaron varias observaciones, las cuales
están contenidas en la siguiente tabla: (Boyle supone que el interior del tubo era
suficientemente uniforme, así que las alturas de las de las columnas de mercurio son
medidas aproximadas de los volúmenes).
Pero en este experimento de prueba, cualquier derrame del mercurio
debe hacerse por grados (una nota de precaución para futuros experimentadores, el
mercurio debe verterse poco a poco), y de acuerdo con las indicaciones del que lleva
nota de la ascensión del mercurio abajo, para lo cual es vertido con precaución, ya
que pude pasar sobre las marcas colocadas en los tubos, antes de poder hacer la
observación.
|
TABLA DE CONDENSACION DEL AIRE |
|
A |
A |
B |
C |
D |
E |
|
48 |
12 |
00 |
Sumado 29 1/8
|
29 2/16 |
29 2/16 |
|
46 |
11 ½ |
01 7/16 |
30 9/16 |
30 6/16 |
|
44 |
11 |
02 13/16 |
31 15/16 |
31 12/16 |
|
42 |
10 ½ |
04 6/16 |
33 8/16 |
33 1/7 |
|
40 |
10 ½ |
06 3/16 |
35 5/16 |
35 |
|
38 |
10 |
07 14/16 |
37 |
36 15/19 |
|
36 |
9 ½ |
10 2/16 |
39 5/16 |
38 7/8 |
|
34 |
8 ½ |
12 8/16 |
41 10/16 |
41 2/17 |
|
32 |
8 |
15 1/16 |
44 3/16 |
43 11/16 |
|
30 |
7 ½ |
17 15/16 |
47 1/16 |
46 3/5 |
|
28 |
7 |
21 3/16 |
50 5/16 |
50 |
|
26 |
6 ½ |
25 3/16 |
54 5/16 |
53 10/3 |
|
24 |
6 ½ |
29 4/16 |
58 13/16 |
58 2/8 |
|
23 |
5 ¾ |
32 3/16 |
61 5/16 |
60 18/23 |
|
22 |
5 ½ |
34 15/16 |
64 1/16 |
63 6/11 |
|
21 |
5 ¼ |
37 15/16 |
67 1/16 |
66 4/7 |
|
20 |
5 |
41 3/16 |
70 11/16 |
70 |
|
19 |
4 ¾ |
45 |
74 2/16 |
73 11/19 |
|
18 |
4 ½ |
48 12/16 |
77 14/16 |
77 2/3 |
|
17 |
4 ¼ |
53 11/16 |
82 12/16 |
82 4/27 |
|
16 |
4 |
58 2/16 |
87 14/16 |
87 3/8 |
|
15 |
3 ¾ |
63 15/16 |
93 1/16 |
93 1/5 |
|
14 |
3 ½ |
71 15/16 |
100 7/16 |
99 6/7 |
|
13 |
3 ½ |
78 15/16 |
107 13/16 |
107 7/13 |
|
12 |
3 |
88 7/16 |
117 9/16 |
116 4/8 |
AA. El número de espacios iguales en el brazo más
corto que contenía la misma cantidad de aire diversamente extendida.
B. La altura del cilindro de mercurio en el brazo más
largo que comprimía el aire en esas dimensiones.
C. La altura del cilindro de mercurio, que
contrabalanceaba la presión de la atmósfera.
D. El agregado de las dos últimas columnas B y C,
presentando la presión mantenida por el aire incluido.
E. Lo que la presión podía hacer de acuerdo a la
hipótesis, que supone a la expansión y a la presión en proporción recíproca.
(Esta columna supone la relación bien conocida: PV=constante).
(La columna D indica que otros efectos como la
temperatura no fueron importantes en estas medidas).
Teniendo por peso un cilindro de mercurio, se comprime
el aire hasta un cuarto del espacio poseído anteriormente, observamos y pensamos que
no puede condensarse más por frío, la flama de una vela cerca nos hace pensar que en
un grado mayor de calor puede expanderse (de lo cual parece que la temperatura es
llevada como constante), pero temiendo la ruptura del tubo, no osamos ponerlo a
prueba.
Del experimento parece que como el aire es más o menos compresible,
es capaz de contrabalancear un cilindro pesado o ligero de mercurio. Y que el mercurio
estaba soportado por la elasticidad del aire condensado pareciendo succionar el aire
de afuera del tubo cuando el mercurio tenía 100 pulgadas de altura en la pipa; por la
presión de la columna obligatoria de la atmósfera, siendo removida por ese medio, el
mercurio fue levantado en el tubo largo por la expansión del aire en el brazo corto
del tubo, y no por cualquier funículo ya que como el objeto confiesa no puede
levantarse más que un cilindro de treinta pulgadas (Franciscus Linus, apoyador de las
doctrinas Aristotélicas había sugerido que el vacío de Torriceli contenido en una
membrana dilatada invisible, llamada funículo, puede ‘tirar’ de una columna de
mercurio a una altura máxima de cerca de treinta pulgadas, F. Linus es el objetor al
que se refiere Boyle).
LA RARIFICACION DEL AIRE CONSIDERADO
Pero, junto con lo que se ha dicho aquí, no sólo puede ilustrarse
un poco de nuestra doctrina sobre la elasticidad del aire sino observar cuánto se
debilita la misma como efecto de la variación y rarificación de la expansión.
A continuación se da una tabla de la rarificación del aire
|
A |
B |
C |
D |
E |
|
1 |
0 |
Resaltado a 29 3/4 |
29 3/4 |
29 3/4 |
|
1 ½ |
10 5/8 |
19 1/8 |
19 5/6 |
|
2 |
15 3/8 |
14 3/8 |
14 7/8 |
|
3 |
20 2/8 |
19 4/8 |
9 15/12 |
|
4 |
22 5/8 |
7 1/8 |
7 7/16 |
|
5 |
24 1/8 |
5 5/8 |
5 19/25 |
|
6 |
24 7/8 |
4 7/8 |
4 23/24 |
|
7 |
25 4/8 |
4 2/8 |
4 1/4 |
|
8 |
26 |
3 6/8 |
3 23/32 |
|
9 |
26 3/8 |
3 3/8 |
3 11/16 |
|
10 |
26 6/8 |
3 |
2 39/40 |
|
12 |
27 1/8 |
2 5/8 |
2 23/48 |
|
14 |
27 4/8 |
2 2/8 |
2 1/8 |
|
16 |
27 6/8 |
2 |
1 55/64 |
|
18 |
27 7/8 |
1 7/8 |
1 47/72 |
|
20 |
28 |
1 6/8 |
1 9/80 |
|
24 |
28 2/8 |
1 4/8 |
1 23/96 |
A. El número de espacios iguales en el tope del tubo, el cual
contiene las mismas partes de aire.
B. La altura del cilindro mercurial, que junto con la elasticidad
del aire incluido contrabalancea la presión de la atmósfera.
C. La presión atmosférica.
D. El complemento de B a C, mostrando la presión sostenida por el
aire incluido.
E. La presión de acuerdo a la hipótesis
En este experimento puede notarse, primero, que podemos usar un tubo
de vidrio de aproximadamente seis pies de longitud, cerrado en un extremo.
En segundo lugar, tenemos en consideración una pipa de vidrio, de
diámetro aproximadamente igual a la de una pluma de cisne (cerca de ¼ de pulgada),
el cual fue marcado con un papel introducido en él, dividido en pulgadas y medio
cuartos, el cual fue sumergido en otro cilindro de mercurio abierto en ambos extremos,
de modo que el mercurio puede levantarlo para llevar el otro extremo. Y con una
pulgada sobre el mercurio, el orificio fue cerrado arriba; así que una pulgada de
aire estaba contenida en el tubo, la cual, levantando el tubo, fue gradualmente
expandida a varias pulgadas. Notando en un tiempo medio en varios pasos, cuánto
mercurio estaba en el tubo pequeño por el aire expandido, permitiendo elevarse sobre
la superficie del mercurio en el otro tubo: por lo cual el método de las
observaciones que fueron hechas al principio. Al invertir el tubo largo, encontramos,
considerando el experimento de Torricelli, que el aire sostenido por el mercurio era
de 29 ¾ de pulgadas, observamos haciendo las medidas anteriores que la diferencia
entre la cantidad la cual contesta nuestra hipótesis y la otra, se debe probablemente
a un nuevo acceso de aire a la pulgada considerada, y realmente, cuando las
observaciones fueron completadas, al remover el tubo encontramos que ha ganado sobre
la mitad un octavo, lo cual juzgamos que puede deberse a alguna burbujas alojadas en
los poros del mercurio. Del experimento parece que la pulgada de aire cuando expande
al doble sus dimensiones, fue capaz, con un cilindro de mercurio de quince pulgadas de
contrabalancear la atmósfera, la cual puede levantar el mercurio ocho y veinte
pulgadas cuando la elasticidad del aire se halla perdido por una expansión (mientras
que el doble del volumen del aire requiere unas quince pulgadas adicionales de
mercurio para soportar la atmósfera, se sigue que la presión está siendo dividida
en dos partes iguales aproximadamente). Así que la atmósfera aquí abajo puede
consecuentemente estar comprimida igual que si veintiocho pulgadas de mercurio
estuvieran sobre ella.
Del libro: Great Experiments in Physics (editado por:
Morris H. Samos; traducido por Ma. Cristina Peña de Noyola, y revisado por M. en C.
Arturo Noyola Isgleas).
|
![]()